Trong vòng vài thập kỷ qua, xuất độ của ung thư tuyến giáp đã gia tăng ở nhiều quốc gia trên thế giới, chủ yếu vì sự phát triển của các phương tiện chẩn đoán, giúp phát hiện những trường hợp ung thư tuyến giáp kích thước nhỏ.
Giới thiệu
Trong vòng vài thập kỷ qua, xuất độ của ung thư tuyến giáp đã gia tăng ở nhiều quốc gia trên thế giới, chủ yếu vì sự phát triển của các phương tiện chẩn đoán, giúp phát hiện những trường hợp ung thư tuyến giáp kích thước nhỏ. Tuy nhiên, tỷ lệ tử vong do ung thư tuyến giáp biệt hóa lại thay đổi rất ít trong vòng nhiều thập kỷ qua. Điều này gợi ý về tính chẩn đoán quá mức ung thư tuyến giáp, nhưng xử trí những trường hợp bệnh tiến triển còn chưa thay đổi nhiều. Các vấn đề chính trong thực hành là làm sao tránh chẩn đoán quá mức ung thư tuyến giáp với nguy cơ thấp, đồng thời phát hiện những trường hợp bệnh tiến triển hoặc nguy cơ cao, cần can thiệp triệt để. Chính vì thế, trong những năm gần đây, chẩn đoán và điều trị ung thư tuyến giáp đã có những thay đổi, như hệ thống chẩn đoán giai đoạn mới của AJCC, công cụ dự đoán và tiên lượng mới, cùng với cách tiếp cận điều trị mới. Bài này sẽ tập trung vào những điểm mới thay đổi trong chẩn đoán và điều trị ung thư tuyến giáp loại biệt hóa tốt.
Chẩn đoán mô bệnh học và hệ thống đánh giá giai đoạn
Trong vài thập kỷ qua, xuất độ ung thư tuyến giáp đã gia tăng đáng kể. Theo thống kê, phần lớn những trường hợp ung thư tuyến giáp được chẩn đoán thì có tới 85% điều trị với cắt giáp toàn phần. Những bệnh nhân này đều có nguy cơ gặp phải những biến chứng trong mổ và biến chứng hậu phẫu, ngoài ra còn cần điều trị với hormone tuyến giáp suốt đời, theo dõi nội tiết tố trong thời gian dài. Một số bệnh nhân còn cần điều trị với phóng xạ, có thể làm tăng nguy cơ những ung thư khác 34. Tuy nhiên, phần lớn những trường hợp ung thư tuyến giáp được chẩn đoán đều thuộc nhóm ung thư tuyến giáp dạng nhú (PTC). Điều này đặt ra vấn đề “chẩn đoán quá mức” trong ung thư tuyến giáp.
Năm 2017, phân loại mô học bướu nội tiết của Tổ chức Y tế Thế giới (WHO) phiên bản thứ tư đã được công bố, và có những điểm thay đổi quan trọng ảnh hưởng đến thực hành lâm sàng (bảng 1)1.
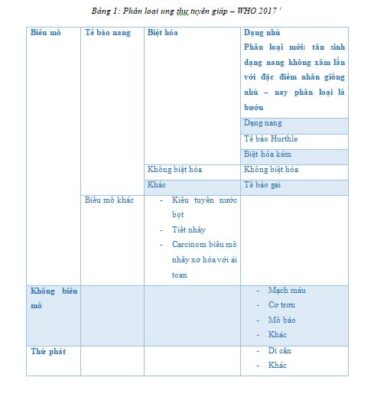
Kiểu tân sinh từ tế bào nang giáp nay đã có một nhóm được xếp loại là bướu với đặc điểm mô học giáp biên: bướu tuyến giáp dạng nang không xâm lấn với đặc điểm nhân dạng nhú (NIFTP-non-invasive follicular thyroid tumor with papillary nuclear features)2,3, đây là một dạng carcinoma tuyến giáp dạng nhú (PTC) biến thể nang trong vỏ bao không có bằng chứng của xâm lấn vỏ bao hoặc xâm lấn mạch máu. Dạng này không được phân loại là ung thư vì tiên lượng rất tốt. Sự thay đổi trong hệ thống phân loại mô học nhằm giảm mức độ điều trị và theo dõi và các hệ quả tâm lý do chẩn đoán ung thư với những dạng bướu này. Tuy nhiên, các bằng chứng về tiên lượng của NIFTP đều dựa trên các nghiên cứu hồi cứu, nên cần thêm các nghiên cứu tiến cứu trong thời gian dài để khẳng định hơn.
Việc phân loại lại NIFTP có thể ảnh hưởng đến hơn 45 ngàn bệnh nhân toàn cầu mỗi năm, và có thể làm giảm những hậu quả liên quan đến chẩn đoán ung thư như sang chấn tâm lý, điều trị quá mức và chi phí y khoa.
Ngoài ra, bảng phân loại còn xác định 15 biến thể của PTC và nhóm ung thư tuyến giáp dạng nang (FTC) chia thành 3 tiểu nhóm (FTC xâm lấn tối thiểu với xâm lấn vỏ bao đơn thuần, FTC xâm lấn mạch máu trong vỏ bao, và FTC xâm lấn rộng), điều này phản ánh tính tiên lượng của xâm lấn mạch máu.
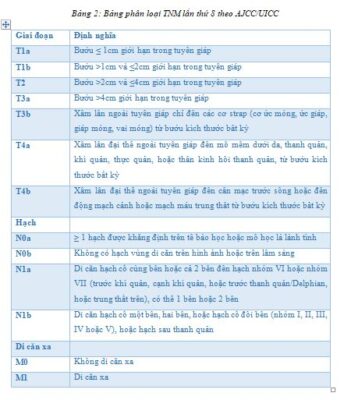
Về đánh giá giai đoạn bệnh đối với ung thư tuyến giáp biệt hóa, Hiệp hội Ung thư Hoa Kỳ và Ủy ban Kiểm soát Ung thư Quốc tế (AJCC/UICC) đã có những thay đổi đáng kể trong bảng phân loại giai đoạn bệnh lần thứ 8 (bắt đầu ứng dụng từ 2018). Độ tuổi để phân biệt hai nhóm đã thay đổi từ 45 lên 55 tuổi, yếu tố xâm lấn ngoài tuyến giáp tối thiểu đã không còn là yếu tố đánh giá giai đoạn T, các giai đoạn đã được sắp xếp lại. Di căn hạch vùng hoặc có xâm lấn đại thể ngoài tuyến giáp vào cơ strap đã không còn xếp vào giai đoạn III, mà là giai đoạn II. Việc thay đổi hệ thống phân loại mới này nhằm đánh giá chính xác hơn về tính dự đoán nguy cơ tử vong của hệ thống phân loại,4 giới hạn lại nhóm nguy cơ cao chỉ ở một nhóm nhỏ bệnh nhân (5-10%) với bướu ở giai đoạn III (pT4a, N bất kỳ, M0) hoặc giai đoạn IV (pT4b, N bất kỳ, M0 và M1). Việc ứng dụng hệ thống TNM lần thứ 8 dự đoán sẽ giúp hạ giai đoạn bệnh ở 30-40% bệnh nhân ung thư tuyến giáp.5,6

Những điểm mới trong xử trí ung thư tuyến giáp biệt hóa
Theo dõi chủ động
Hướng dẫn thực hành của Hiệp hội Tuyến giáp Hoa Kỳ (ATA) năm 2015 7 đã đề nghị theo dõi chủ động trong xử trí những trường hợp ung thư tuyến giáp dạng nhú kích thước nhỏ. Đề nghị này xuất phát từ các nghiên cứu của Nhật Bản8,9: sau 10 năm, rất ít bệnh nhân có bướu phát triển (8%), di căn hạch cũng chiếm tỷ lệ rất thấp (4%). Và phẫu thuật trì hoãn cũng đem lại hiệu quả như phẫu thuật tức thì 10. Một nghiên cứu khác tại Mỹ với 291 bệnh nhân có nhân giáp ác tính hoặc nghi ngờ ác tính, kích thước từ 1,5cm trở xuống, được theo dõi chủ động trong thời gian trung vị 2 năm11. Tỷ lệ bướu phát triển chỉ 2,5% tại thời điểm 2 năm, và 12% tại thời điểm 5 năm. Yếu tố dự đoán bướu phát triển độc lập gồm dưới 50 tuổi, và lâm sàng có yếu tố “không thể theo dõi chủ động”11. Việc không thể theo dõi có thể dựa trên nhiều yếu tố, gồm các yếu tố liên quan đến bướu (bướu nằm sát thần kinh hồi thanh quản, nghi ngờ xâm lấn ngoài tuyến giáp, xâm lấn thần kinh hoặc khí quản, FNA cho kết quả nghi ngờ mô học không thuận lợi, và tăng kích thước hạt giáp PTC tối thiểu 3mm khi theo dõi), và các yếu tố liên quan đến bệnh nhân (dưới 18 tuổi, từ chối theo dõi đơn thuần, không tuân thủ tốt phác đồ theo dõi), hoặc yếu tố liên quan đến bác sĩ (ít kinh nghiệm xử trí ung thư tuyến giáp hoặc siêu âm cổ), hoặc kết hợp các yếu tố trên12.
Tiếp cận phẫu thuật
Theo hướng dẫn của ATA7, cắt thùy là lựa chọn phù hợp cho bướu nguy cơ thấp, không xâm lấn ngoài tuyến giáp, với kích thước lên tới 4cm, và không có tổn thương ở thùy đối bên. Cắt thùy đem lại nhiều lợi ích hơn so với cắt giáp toàn phần. Đầu tiên là tỷ lệ biến chứng thấp hơn, tỷ lệ suy phó giáp và liệt thần kinh hồi thanh quản đều giảm. Ngoài ra, còn tránh suy chức năng tuyến giáp cần bổ sung nội tiết tố suốt đời 17,18,19. Tuy nhiên, trong một nghiên cứu hồi cứu trên 52.173 trường hợp dựa trên dữ liệu của SEER (Surveillance Epidemiology and End Results), cắt thùy đối với bướu dưới 1cm có liên quan với việc tăng nguy cơ tái phát, dù thấp nhưng có ý nghĩa thống kê, khi so với cắt giáp toàn phần (9,8% so với 7,7%) và tăng tỷ lệ tử vong (2,9% so với 1,6%)13. Khi tái phát, các nghiên cứu ghi nhận tái phát xảy ra ở thùy đối bên chiếm 5% bệnh nhân cắt thùy14, và tái phát nhân giáp lành tính chiếm đến 20-50%15,16.
Hướng dẫn của ATA cũng khuyến cáo không nạo hạch cổ phòng ngừa đối với bệnh nhân nguy cơ thấp, dù tần suất di căn hạch dưới lâm sàng khá cao trong PTC7. Thực tế, di căn hạch không được phát hiện trên lâm sàng có ảnh hưởng thế nào đến tiên lượng bệnh nhân còn chưa rõ20, và nạo hạch cổ nhóm trung tâm phòng ngừa còn làm tăng tỷ lệ biến chứng, như suy cận giáp, mà còn không cải thiện kết cục so với việc không nạo hạch phòng ngừa21.
Phẫu thuật xâm lấn tối thiểu
Chúng ta đã rất xa khoảng thời gian phẫu thuật tuyến giáp theo đường dọc theo cổ. Hiện nay, đường rạch da không chỉ theo đường nếp cổ, mà còn có kích thước ngày càng nhỏ lại, giúp sẹo mổ ngày càng nhỏ lại. Gần đây, Miccolli và cộng sự tại Ý đã phát triển kỹ thuật mổ cắt giáp qua đường mổ <2cm xâm lấn tối thiểu (MIVAT – cắt giáp xâm lấn tối thiểu có video hỗ trợ) 35. Tuy nhiên, kỹ thuật này không được sự chấp thuận rộng rãi trên toàn cầu, vì vẫn còn sẹo mổ trên cổ (đôi khi sẹo mổ 2cm căng kéo nhiều lại lành thương kém hơn sẹo mổ 4-5cm). Hơn nữa, kỹ thuật này cần tối thiểu 2 phẫu thuật viên có kinh nghiệm và 1 hoặc 2 người phụ mổ, điều này không phải là tiêu chuẩn tại Ý. Từ kỹ thuật này, rất nhiều phẫu thuật viên đã cố gắng tìm đường phẫu thuật ngoài vùng cổ, đặc biệt ở Châu Á. Đã có nhiều đường tiếp cận được mô tả: dưới đòn, quanh núm vú, nách, đường sau tai,… tất cả đều dùng nội soi hoặc qua robot. Các tác giả tại Geneva đã sử dụng phẫu thuật cắt giáp qua đường nách bằng Robot Da Vinci, tuy nhiên phẫu thuật này cũng như các phẫu thuật khác, không đạt tính “xâm lấn tối thiểu”.
…..
Điều trị diệt giáp với Iod phóng xạ
Trước đây, điều trị diệt giáp với Iod phóng xạ được xem là thường quy sau phẫu thuật, nhằm loại trừ các mô giáp còn lại sau phẫu thuật, đạt đồng độ Tg trong mức không thể phát hiện, cho phép phát hiện mô tồn lưu trên xạ hình toàn thân với Iod 131. Những chỉ định này đã được xem xét lại trong nhiều năm nay. Hướng dẫn của ATA đã khuyến cáo chỉ sử dụng Iod phóng xạ diệt giáp cho những trường hợp chọn lọc dựa trên nguy cơ từng cá nhân7. Tuy nhiên, Hiệp hội Y học Hạt nhân Châu Âu không đồng ý áp dụng hướng dẫn của ATA, và ghi nhận rằng không có nghiên cứu tiến cứu, có nhóm chứng nào cho thấy bệnh nhân PTC nguy cơ thấp không được lợi ích gì khi điều trị diệt giáp với Iod 13133.
Tuy còn tranh cãi, nhưng một điều đã được chấp thuận chung là điều trị diệt giáp với Iod phóng xạ không có vai trò trong xử trí ung thư tuyến giáp kích thước nhỏ. Trong các trường hợp nguy cơ thấp – trung bình khác, cần dựa vào từng yếu tố tiên lượng của người bệnh, và nồng độ Tg tại thời điểm 6 tuần sau mổ. Nếu nồng độ Tg thấp không phát hiện được gợi ý không cần điều trị diệt giáp với Iod phóng xạ23. Hiện tại, có 2 thử nghiệm lâm sàng đang được tiến hành nhằm đưa ra bằng chứng về chỉ định điều trị phóng xạ sau mổ, là thử nghiệm NCT01837745 tại Pháp và NCT01398085 tại Anh.
Theo dõi sau điều trị
Phương tiện chính để theo dõi là siêu âm cổ và nồng độ Tg24. Nồng độ Tg không phát hiện được có giá trị dự đoán âm tính gần 100%, giúp xác định bệnh nhân không tái phát. Ngược lại, nồng độ Tg phát hiện được tối thiểu có giá trị tiên đoán dương khá thấp: phần lớn bệnh nhân vẫn không có bệnh tái phát cấu trúc trong quá trình theo dõi 25. Quan trọng hơn là xu hướng của Tg theo thời gian, chứ không phải giá trị tại một thời điểm, nồng độ tăng dần gợi ý sự hiện diện của mô giáp đang phát triển (bình thường hoặc tân sinh)26. Khi có sự hiện diện của kháng thể kháng Tg (TgAbs), nồng độ Tg phát hiện bằng phương pháp miễn dịch có thể bị thấp giả tạo. Xét nghiệm Tg nhạy có thể phát hiện nồng độ thấp từ mức 0,1ng/mL, đã được sử dụng và cho kết quả cũng tượng tự như Tg kích thích bởi rhTSH. Nồng độ Tg kích thích bởi RhTSH đang được dùng trong theo dõi những bệnh nhân có nồng độ Tg thấp nhưng phát hiện được khi đang điều trị LT4. Trên những bệnh nhân này, việc tăng nồng độ Tg kích thích có thể chỉ điểm bướu tân sinh 27.
Siêu âm cổ cũng giúp theo dõi bệnh, và cho những thông tin hữu ích. PTC thường luôn di căn đầu tiên đến hạch cổ, siêu âm có thể giúp phát hiện ra, do đó không cần dùng để xạ hình toàn thân. Siêu âm được cho thấy có tính chi phí-hiệu quả, không phơi nhiễm phóng xạ, và không có tác dụng phụ. Điều trị phẫu thuật hạch cổ di căn được chỉ định khi có hạch cổ bên di căn từ 10mm, và hạch cổ trung tâm từ 8mm 7. Tuy nhiên, siêu âm là thủ thuật phụ thuộc người thực hiện, và một số kết quả của siêu âm không đặc hiệu hoặc không thể xác định được. Những kết quả nghi ngờ thì có thể khẳng định bằng FNA và đo nồng độ Tg trong dịch rửa kim28. Hiếm khi gặp trường hợp di căn xa khi siêu âm cổ âm tính. Tuy nhiên, khi Tg tăng hoặc có đặc điểm lâm sàng nghi ngờ, thì các xét nghiệm hình ảnh học tiếp theo (như xạ hình toàn thân với Iod phóng xạ chẩn đoán hoặc 18-FDG PET-scan, CT-scan, MRI) có thể giúp xác định 29.
Đánh giá nguy cơ khi theo dõi là một quá trình thay đổi: đáp ứng với điều trị được đánh giá lại mỗi khi tái khám và sẽ được đánh giá là tốt, trung bình, không hoàn toàn về mặt sinh hóa, hoặc không hoàn toàn về mặt cấu trúc. Khi đánh giá nguy cơ thay đổi, kế hoạch theo dõi có thể thay đổi theo. Việc theo dõi lâu dài được khuyến cáo 7. Tuy nhiên, hơn 75% tổn thương tái phát được phát hiện trong vòng 5 năm đầu theo dõi, và tái phát muộn thường rất ít gặp ở những bệnh nhân nguy cơ thấp hoặc trung bình với đáp ứng tốt với điều trị 30.
TSH kích thích sự phát triển của tế bào tuyến giáp bình thường và tế bào tân sinh, và liệu pháp levothyroxine làm giảm đáng kể tái phát và tử vong liên quan đến bệnh31. Nồng độ TSH tối ưu còn chưa rõ. Liệu pháp ức chế TSH làm tăng nguy cơ rung nhĩ và loãng xương trên bệnh nhân lớn tuổi, và nguy cơ đau thắt ngực trên bệnh nhân có bệnh tim thiếu máu 32. Khi điều trị liệu pháp ức chế nên chú ý đến các biến chứng, và cân bằng với nguy cơ bướu phát triển. Chính vì thế, liệu pháp ức chế với levothyroxine đã không còn được chỉ định cho bệnh nhân nguy cơ thấp hoặc trung bình. Đối với những trường hợp này, TSH chỉ cần trong giới hạn bình thường 7.
Kết luận
Ung thư tuyến giáp với xuất độ ngày càng gia tăng nên luôn là mối quan tâm của các nhà lâm sàng trên toàn thế giới. Những thay đổi gần đây trong phân loại mô bệnh học cũng như trong phân loại giai đoạn bệnh, cùng với thay đổi về hướng dẫn thực hành của ATA cho thấy xu hướng giảm tính xâm lấn cho ung thư tuyến giáp loại biệt hóa. Việc thực hành điều trị ung thư tuyến giáp biệt hóa cần được cá thể hóa, xem xét từng khía cạnh của người bệnh để có quyết định điều trị đúng đắn.
BSCK2. Trương Thành Trí
CHUYÊN KHOA UNG BƯỚU
Tài liệu tham khảo
- WHO Classifcation of Tumours of Endocrine Organs. Fourth Edition ed. Geneve: World Health Organization; 2017.
- Haugen BR, Sawka AM, Alexander EK, et al.: American Thyroid Association Guidelines on the Management of Thyroid Nodules and Differentiated Thyroid Cancer Task Force Review and Recommendation on the Proposed Renaming of Encapsulated Follicular Variant Papillary Thyroid Carcinoma Without Invasion to Noninvasive Follicular Thyroid Neoplasm with Papillary-Like Nuclear Features. Thyroid. 2017; 27(4): 481–3.
- Nikiforov YE, Seethala RR, Tallini G, et al.: Nomenclature Revision for Encapsulated Follicular Variant of Papillary Thyroid Carcinoma: A Paradigm Shift to Reduce Overtreatment of Indolent Tumors. JAMA Oncol. 2016; 2(8): 1023–9.
- Kim TH, Kim YN, Kim HI, et al.: Prognostic value of the eighth edition AJCC TNM classifcation for differentiated thyroid carcinoma. Oral Oncol. 2017; 71: 81–6.
- Kim M, Kim WG, Oh HS, et al.: Comparison of the Seventh and Eighth Editions of the American Joint Committee on Cancer/Union for International Cancer Control Tumor-Node-Metastasis Staging System for Differentiated Thyroid Cancer. Thyroid. 2017; 27(9): 1149–55.
- Tuttle RM, Haugen B, Perrier ND: Updated American Joint Committee on Cancer/Tumor-Node-Metastasis Staging System for Differentiated and Anaplastic Thyroid Cancer (Eighth Edition): What Changed and Why? Thyroid. 2017; 27(6): 751–6.
- Haugen BR, Alexander EK, Bible KC, et al.: 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016; 26(1): 1–133.
- Ito Y, Miyauchi A, Inoue H, et al.: An observational trial for papillary thyroid microcarcinoma in Japanese patients. World J Surg. 2010; 34(1): 28–35.
- Oda H, Miyauchi A, Ito Y, et al.: Incidences of Unfavorable Events in the Management of Low-Risk Papillary Microcarcinoma of the Thyroid by Active Surveillance Versus Immediate Surgery. Thyroid. 2016; 26(1): 150–5.
- Ito Y, Miyauchi A, Kihara M, et al.: Patient age is signifcantly related to the progression of papillary microcarcinoma of the thyroid under observation. Thyroid. 2014; 24(1): 27–34.
- Tuttle RM, Fagin JA, Minkowitz G, et al.: Natural History and Tumor Volume Kinetics of Papillary Thyroid Cancers During Active Surveillance. JAMA Otolaryngol Head Neck Surg. 2017; 143(10): 1015–20.
- Brito JP, Ito Y, Miyauchi A, et al.: A Clinical Framework to Facilitate Risk Stratifcation When Considering an Active Surveillance Alternative to Immediate Biopsy and Surgery in Papillary Microcarcinoma. Thyroid. 2016; 26(1): 144–9.
- Bilimoria KY, Bentrem DJ, Ko CY, et al.: Extent of surgery affects survival for papillary thyroid cancer. Ann Surg. 2007; 246(3): 375–81; discussion 381–4.
- Matsuzu K, Sugino K, Masudo K, et al.: Thyroid lobectomy for papillary thyroid cancer: long-term follow-up study of 1,088 cases. World J Surg. 2014; 38(1): 68–79.
- Antunes CM, Taveira-Gomes A: Lobectomy in follicular thyroid neoplasms’ treatment. Int J Surg. 2013; 11(9): 919–22.
- Lytrivi M, Kyrilli A, Burniat A, et al.: Thyroid lobectomy is an effective option for unilateral benign nodular disease. Clin Endocrinol (Oxf). 2016; 85(4): 602–8.
- Rosato L, Avenia N, Bernante P, et al.: Complications of thyroid surgery: analysis of a multicentric study on 14,934 patients operated on in Italy over 5 years. World J Surg. 2004; 28(3): 271–6.
- Balentine CJ, Domingo RP, Patel R, et al.: Thyroid lobectomy for indeterminate FNA: not without consequences. J Surg Res. 2013; 184(1): 189–92.
- Lee DY, Seok J, Jeong WJ, et al.: Prediction of thyroid hormone supplementation after thyroid lobectomy. J Surg Res. 2015; 193(1): 273–8.
- Randolph GW, Duh Q, Heller KS, et al.: The prognostic significance of nodal metastases from papillary thyroid carcinoma can be stratified based on the size and number of metastatic lymph nodes, as well as the presence of extranodal extension. Thyroid. 2012; 22(11): 1144–52.
- Viola D, Materazzi G, Valerio L, et al.: Prophylactic central compartment lymph node dissection in papillary thyroid carcinoma: clinical implications derived from the first prospective randomized controlled single institution study. J Clin Endocrinol Metab. 2015; 100(4): 1316–24.
- American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, Cooper DS, Doherty GM, et al.: Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid. 2009; 19(11): 1167–214.
- Schlumberger M, Catargi B, Borget I, et al.: Strategies of radioiodine ablation in patients with low-risk thyroid cancer. N Engl J Med. 2012; 366(18): 1663–73.
- Durante C, Attard M, Torlontano M, et al.: Identification and optimal postsurgical follow-up of patients with very low-risk papillary thyroid microcarcinomas. J Clin Endocrinol Metab. 2010; 95(11): 4882–8.
- Vaisman F, Momesso D, Bulzico DA, et al.: Spontaneous remission in thyroid cancer patients after biochemical incomplete response to initial therapy. Clin Endocrinol (Oxf). 2012; 77(1): 132–8.
- Durante C, Montesano T, Attard M, et al.: Long-term surveillance of papillary thyroid cancer patients who do not undergo postoperative radioiodine remnant ablation: is there a role for serum thyroglobulin measurement? J Clin Endocrinol Metab. 2012; 97(8): 2748–53.
- Brassard M, Borget I, Edet-Sanson A, et al.: Long-term follow-up of patients with papillary and follicular thyroid cancer: a prospective study on 715 patients. J Clin Endocrinol Metab. 2011; 96(5): 1352–9.
- Grani G, Fumarola A: Thyroglobulin in lymph node fne-needle aspiration washout: a systematic review and meta-analysis of diagnostic accuracy. J Clin Endocrinol Metab. 2014; 99(6): 1970–82.
- Lamartina L, Deandreis D, Durante C, et al.: ENDOCRINE TUMOURS: Imaging in the follow-up of differentiated thyroid cancer: current evidence and future perspectives for a risk-adapted approach. Eur J Endocrinol. 2016; 175(5): R185–202.
- Durante C, Montesano T, Torlontano M, et al.: Papillary thyroid cancer: time course of recurrences during postsurgery surveillance. J Clin Endocrinol Metab. 2013; 98(2): 636–42.
- Mazzaferri EL, Kloos RT: Clinical review 128: Current approaches to primary therapy for papillary and follicular thyroid cancer. J Clin Endocrinol Metab. 2001; 86(4): 1447–63.
- Biondi B, Cooper DS: Benefts of thyrotropin suppression versus the risks of adverse effects in differentiated thyroid cancer. Thyroid. 2010; 20(2): 135–46.
- Verburg FA, Aktolun C, Chiti A, et al.: Why the European Association of Nuclear Medicine has declined to endorse the 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer. Eur J Nucl Med Mol Imaging. 2016; 43(6): 1001–5.
- Davies L, Welch HG, Current thyroid cancer trends in the United States. JAMA Otolaryngology. Head & Neck Surgery. 2014; 140 (4): 317–322.
- Miccoli P, Minuto MN, Ugolini C, Pisano R, Fosso A, Berti P. Minimally invasive video-assisted thyroidectomy for benign thyroid disease: an evidence-based review. World J Surg. 2008;32(7):1333–40.